ОСОБЕННОСТИ ПРИМЕНЕНИЯ КРАСИТЕЛЯ НИЛЬСКИЙ КРАСНЫЙ ДЛЯ ИДЕНТИФИКАЦИИ ЧАСТИЦ ПЛАСТИКА В ПРИРОДНЫХ ОБЪЕКТАХ
Ключевые слова:
микропластик, Нильский красный, флуоресцентная микроскопияАннотация
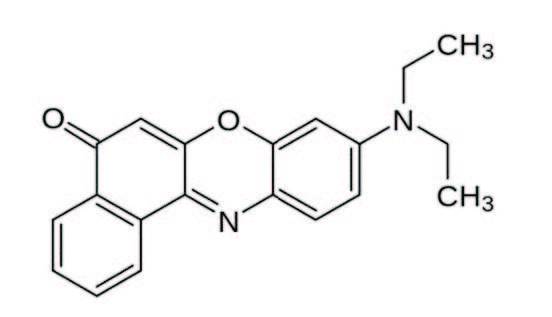
В настоящее время фрагменты искусственных полимеров встречаются во всех средах: в водной толще, донных отложениях, почвах, льдах. Проблема загрязнения окружающей среды частицами пластика стала исследоваться сравнительно недавно, поэтому в настоящий момент не существует стандартизированных методик для анализа данного типа частиц в природных объектах. При качественном и количественном исследовании микропластика возникает ряд сложностей. Зачастую встает вопрос о необходимости применения трудоемких методов и дорогостоящего оборудования для точной идентификации пластиковых фрагментов. Использование различных красителей в сочетании с флуоресцентной микроскопией является более доступным методом, в сравнении со спектральным анализом. В данной работе рассмотрены особенности применения липофильного красителя Нильский красный для упрощения процесса идентификации частиц наиболее распространенных типов пластика. Сделаны выводы о применимости красителя для каждого из проанализированных полимеров на определенных длинах волн (330–385 нм и 510–560 нм). Кроме этого, Нильский красный использовался для анализа частиц микропластика, выделенных из вод притока Ладожского озера (р. Морье). Результаты показали, что данный метод хорошо подходит для визуального отделения пластика от биологических остатков, в частности, хитиновых фрагментов, которые зачастую могут быть ошибочно приняты за частицы искусственных полимеров.
Библиографические ссылки
Andrady A.L. Measurement and occurrence of microplastics in the environment. Presentation at the 2nd Research workshop on microplastic debris. Tacoma, 2010.
Andrady A.L. Microplastics in the marine environment // Marine pollution bulletin. 2011. V. 62. P. 1596–1605. doi: 10.1016/j.marpolbul.2011.05.030.
Browne M.A., Galloway T.S. Spatial Patterns of plastic debris along estuarine shorelines // Environmental science & technology. 2010. V. 44(9). P. 3404–9. doi: 10.1021/es903784e.
Cincinelli A., Scopetani C., Chelazzi D., Lombardini E., Martellini T., Katsoyiannis A., Fossi M.C., Corsolini S. Microplastic in the surface waters of the Ross Sea (Antarctica): Occurrence, distribution and characterization by FTIR // Chemosphere. 2017. V. 175. P. 391–400. doi: 10.1016/j.chemosphere.2017.02.024.
Corradini F., Meza P., Eguiluz R., Casado F., Huerta-Lwanga E., Geissen V. Evidence of microplastic accumulation in agricultural soils from sewage sludge disposal // Science of the total environment. 2019. V. 671. P. 411–420. doi: 10.1016/j.scitotenv.2019.03.368.
Cózar A., Martí E., Duarte C.M., Garcia-de-Lomas J., van Sebille E., Ballatore T.J., Eguíluz V.M., González-Gordillo J.I., Pedrotti M.L., Echevarría F., Troublè F., Irigoien X. The Arctic Ocean as a dead end for floating plastics in the North Atlantic branch of the thermohaline circulation // Science advances. 2017. V. 3(4). doi: 10.1126/sciadv.1600582.
Erni-Cassola G., Gibson M.I., Thompson R.C., Christie-Oleza J.A. Lost, but found with Nile red; a novel method to detect and quantify small microplastics (20 µm–1 mm) in environmental samples // Environmental science and technology. 2017. V. 51(23). P. 13641–13648. doi: 10.1021/acs.est.7b04512.
Greenspan P., Mayer E.P., Fowler S.D. Nile red: a selective fluorescent stain for intracellular lipid droplets // Journal of cell biology. 1985. V. 100(3). P. 965–973. doi: 10.1083/jcb.100.3.965.
Maes T., Jessop R., Wellner N., Haupt K., Mayes A.G. A rapid-screening approach to detect and quantify microplastics based on fluorescent tagging with Nile red // Scientific reports. 2017. V. 7(1). doi: 10.1038/srep44501.
Pozdnyakov Sh.R., Ivanova E.V., Guzeva A.V., Shalunova E.P., Martinson K.D., Tikhonova D.A. Studying the concentration of microplastic particles in water, bottom sediments and subsoils in the coastal area of the Neva bay, the Gulf of Finland // Water resources. 2020. V. 47, No 4. P. 599–607. doi: 10.1134/S0097807820040132.
Shim W.J., Song Y.K., Hong S.H., Jang M. Identification and quantification of microplastics using Nile Red staining // Marine pollution bulletin. 2016. Vol. 113(1–2). P. 469–476. doi: 10.1016/j.marpolbul.2016.10.049.
Tamminga M., Hengstmann E., Fischer E.K. Nile Red staining as a subsidiary method for microplastic quantification: a comparison of three solvents and factors influencing application reliability // Journal of Earth sciences & environmental studies. 2017. V. 2(2). P. 165–172. doi: 10.15436/JESES.2.2.1.
Zobkov M., Esiukova E. Microplastics in Baltic bottom sediments: Quantification procedures and first results // Marine pollution bulletin. 2017. V. 114. P. 724–732. doi: 10.1016/j.marpolbul.2016.10.060.
Библиографические ссылки
Andrady A.L. Measurement and occurrence of microplastics in the environment. Presentation at the 2nd Research workshop on microplastic debris. Tacoma, 2010.
Andrady A.L. Microplastics in the marine environment // Marine pollution bulletin. 2011. Vol. 62. P. 1596–1605. doi: 10.1016/j.marpolbul.2011.05.030.
Browne M.A., Galloway T.S. Spatial Patterns of plastic debris along estuarine shorelines // Environmental science & technology. 2010. Vol. 44(9). P. 3404–9. doi: 10.1021/es903784e.
Cincinelli A., Scopetani C., Chelazzi D., Lombardini E., Martellini T., Katsoyiannis A., Fossi M.C., Corsolini S. Microplastic in the surface waters of the Ross Sea (Antarctica): Occurrence, distribution and characterization by FTIR // Chemosphere. 2017. Vol. 175. P. 391–400. doi: 10.1016/j.chemosphere.2017.02.024.
Corradini F., Meza P., Eguiluz R., Casado F., Huerta-Lwanga E., Geissen V. Evidence of microplastic accumulation in agricultural soils from sewage sludge disposal // Science of the total environment. 2019. Vol. 671. P. 411–420. doi: 10.1016/j.scitotenv.2019.03.368.
Cózar A., Martí E., Duarte C.M., Garcia-de-Lomas J., van Sebille E., Ballatore T.J., Eguíluz V.M., González-Gordillo J.I., Pedrotti M.L., Echevarría F., Troublè F., Irigoien X. The Arctic Ocean as a dead end for floating plastics in the North Atlantic branch of the thermohaline circulation // Science advances. 2017. Vol. 3(4). doi: 10.1126/sciadv.1600582.
Erni-Cassola G., Gibson M.I., Thompson R.C., Christie-Oleza J.A. Lost, but found with Nile red; a novel method to detect and quantify small microplastics (20 µm–1 mm) in environmental samples // Environmental science and technology. 2017. Vol. 51(23). P. 13641–13648. doi: 10.1021/acs.est.7b04512.
Greenspan P., Mayer E.P., Fowler S.D. Nile red: a selective fluorescent stain for intracellular lipid droplets // Journal of cell biology. 1985. Vol. 100(3). P. 965–973. doi: 10.1083/jcb.100.3.965.
Maes T., Jessop R., Wellner N., Haupt K., Mayes A.G. A rapid-screening approach to detect and quantify microplastics based on fluorescent tagging with Nile red // Scientific reports. 2017. Vol. 7(1). doi: 10.1038/srep44501.
Pozdnyakov Sh.R., Ivanova E.V., Guzeva A.V., Shalunova E.P., Martinson K.D., Tikhonova D.A. Studying the concentration of microplastic particles in water, bottom sediments and subsoils in the coastal area of the Neva bay, the Gulf of Finland // Water resources. 2020. Vol. 47, No 4. P. 599–607. doi: 10.1134/S0097807820040132.
Shim W.J., Song Y.K., Hong S.H., Jang M. Identification and quantification of microplastics using Nile red staining // Marine pollution bulletin. 2016. Vol. 113(1–2). P. 469–476. doi: 10.1016/j.marpolbul.2016.10.049.
Tamminga M., Hengstmann E., Fischer E.K. Nile Red staining as a subsidiary method for microplastic quantification: a comparison of three solvents and factors influencing application reliability // Journal of Earth sciences & environmental studies. 2017. Vol. 2(2). P. 165–172. doi: 10.15436/JESES.2.2.1.
Zobkov M., Esiukova E. Microplastics in Baltic bottom sediments: Quantification procedures and first results // Marine pollution bulletin. 2017. Vol. 114. P. 724–732. doi: 10.1016/j.marpolbul.2016.10.060.